TOLVAPTÁN
Encuentran una carabina farmacológica 'casi universal' para enfermedades raras
Investigadores del Centro de Regulación Genómica de Barcelona han descubierto que el tolvaptán, un medicamento aprobado para afecciones renales, puede estabilizar casi todas las versiones mutadas de una proteína humana, independientemente del lugar donde se produzca la mutación en la secuencia.
Publicidad
Un estudio publicado en Nature Structural & Molecular Biology demuestra por primera vez que un único fármaco, ya autorizado para uso médico, puede estabilizar casi todas las versiones mutadas de una proteína humana, independientemente del lugar donde se produzca la mutación en la secuencia.
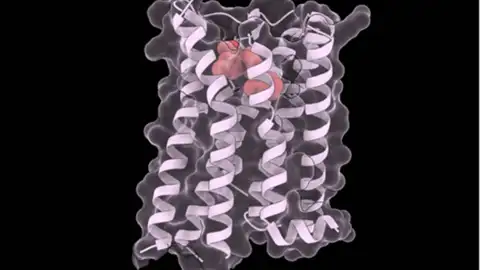
Los autores del estudio generaron siete mil versiones del receptor de vasopresina V2 (V2R), esencial para la función renal normal. Recrearon en el laboratorio todas las variantes mutadas posibles. Las mutaciones defectuosas en V2R impiden que las células renales respondan a la hormona vasopresina, lo que provoca incapacidad para concentrar la orina. Esto se traduce en sed excesiva y producción de grandes volúmenes de orina diluida, causando la diabetes insípida nefrogénica (NDI), también conocida como resistencia a la vasopresina arginina. Esta enfermedad rara afecta aproximadamente a una de cada 25.000 personas.
En experimentos adicionales centrados en mutaciones observadas en pacientes, se comprobó que el fármaco oral tolvaptán, aprobado clínicamente para otras afecciones renales, restauró los niveles del receptor a valores casi normales en el 87% de las mutaciones desestabilizadas. Esto incluye 60 de las 69 mutaciones conocidas causantes de enfermedad y 835 de las 965 mutaciones pronosticadas como patogénicas.
"Dentro de la célula, el V2R viaja a través de un sistema de tráfico estrictamente regulado. Las mutaciones provocan un atasco, de modo que el receptor nunca llega a la superficie. El tolvaptán estabiliza el receptor el tiempo suficiente para que el sistema de control de calidad de la célula lo deje pasar", explica Taylor Mighell, primer autor del estudio e investigador posdoctoral en el CRG de Barcelona.
Primera prueba de concepto
El grupo de investigación ya había demostrado que muchas mutaciones alteran la estabilidad de las proteínas, lo que afecta a su función. Este medicamento actúa sin importar dónde se localice la mutación, ya que las proteínas alternan entre formas plegadas y desplegadas. En el caso del receptor V2R, la mayoría de las mutaciones favorecen la forma desplegada, que es menos estable. Al unirse al receptor, el tolvaptán favorece la forma plegada, más funcional.
La investigación constituye la primera prueba de concepto que demuestra que un fármaco puede actuar como una carabina farmacológica 'casi universal'. Es decir, una molécula capaz de unirse a una proteína y estabilizar su estructura sin importar dónde se haya producido la mutación. En este caso, el efecto se observó en casi nueve de cada diez situaciones.
Un reto histórico
Los hallazgos podrían ayudar a abordar un desafío histórico en el ámbito de las enfermedades raras. Se considera enfermedad rara cualquier patología que afecta a menos de una persona por cada 2.000. Aunque su prevalencia individual es baja, existen miles de tipos distintos, lo que supone unos 300 millones de personas en todo el mundo que conviven con alguna de estas afecciones.
La mayoría de las enfermedades raras están provocadas por mutaciones en el ADN. Un mismo gen puede mutar de muchas formas diferentes, de modo que los pacientes con la misma enfermedad rara pueden presentar mutaciones distintas como causa del trastorno. Como pocas personas comparten la misma mutación, el desarrollo de fármacos es lento y poco atractivo desde el punto de vista comercial. Por ello, la mayoría de los tratamientos existentes ayudan a controlar los síntomas en lugar de atacar la raíz de la enfermedad.
Estudios previos muestran que entre un 40% y un 60% de las mutaciones que causan enfermedades raras afectan a la estabilidad de las proteínas. Si futuras investigaciones confirman que los receptores rescatados funcionan con normalidad, este estudio ofrece una nueva hoja de ruta para el desarrollo de fármacos. En lugar de buscar un medicamento que actúe contra una única mutación, se podría intentar encontrar uno que estabilice toda una proteína.
La mayor familia de receptores
El V2R forma parte de la mayor familia de receptores del cuerpo humano, conocidos como receptores acoplados a proteínas G (GPCR, por sus siglas en inglés). Este conjunto de aproximadamente 800 genes constituye la diana de alrededor de un tercio de todos los medicamentos aprobados. Numerosas enfermedades raras y comunes surgen cuando los GPCR no se pliegan o no se transportan correctamente hasta la superficie celular, aunque sus partes de señalización permanezcan en gran medida intactas.
"Si el comportamiento que hemos observado se reproduce en otros miembros de la familia de los GPCR, los creadores de fármacos podrían ahorrarse años de búsqueda de moléculas terapéuticas a medida y centrarse en la búsqueda de carabinas farmacológicas generales o universales, acelerando enormemente el proceso de desarrollo de fármacos para muchas enfermedades genéticas", concluye el profesor de investigación ICREA Ben Lehner, jefe de grupo en el Wellcome Sanger Institute (Hinxton, Reino Unido) y en el CRG.
Publicidad






